Os animais não devem ser submetidos a dor ou ao sofrimento desnecessário. O design experimental deve oferecer todas as possibilidades de lhes salvaguardar em qualquer que seja o procedimento. Causar algum nível de dor ou angústia é inevitável, considerando principalmente que às vezes devemos induzir doença para estudar a doença. No entanto, continua sendo nossa responsabilidade procurar maneiras de realizar as metologias específicas de um programa de pesquisa, mantendo o nível de dor ou angústia dentro de um mínimo absoluto.
Antecipar quando a dor pode ocorrer e formular um plano de controle da dor são componentes importantes para minimizá-la. Tratamentos adjuvantes, como fluidoterapia, fornecimento de fonte de calor suplementar, de uma fonte altamente palatável de nutrição, de cama de contato mais macia podem ser outras estratégias para minimizar a dor e a angústia. Adicionalmente, o mais importante, é que o planejamento científico deve ser realizado prevendo o ponto em que a pesquisa deve ser interrompida para minimizar a dor e o distresse ao animal e, ao mesmo tempo, alcançar os objetivos científicos. Esse é o momento definido de maneira simplificada como o ponto final humanitário (PFH).
O termo “Ponto final Humanitário” ou “Endpoints” (Figura 1) é, portanto, definido como o ponto em que a dor e/ou angústia de um animal em experimentação é encerrado, minimizado ou reduzido tomando ações como a eutanásia, encerramento do procedimento doloroso, ou tratamento para a dor e/ou angústia. Um PFH também pode envolver a restauração de um requisito básico, como por exemplo, a retirada de uma dieta experimental intragável e restauração de uma dieta palatável em um determinado nível de perda de peso do animal ou a restauração da convivência em grupo para uma espécie social onde o isolamento está determinado a causar angústia.
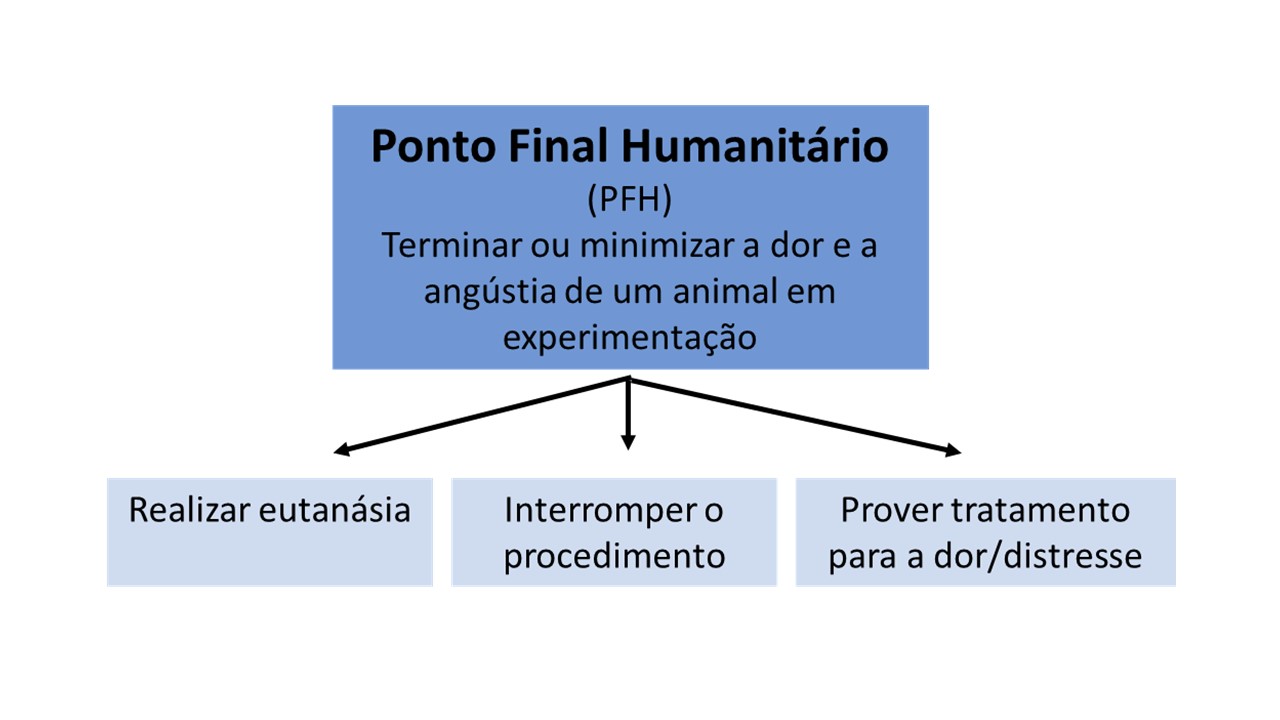
Figura 1. Procedimentos que permitem minimizar a dor ou o estresse a serem estabelecidos no ponto final humanitário.
Quando é realizado um procedimento invasivo que tenha possíveis efeitos letais, geralmente há uma progressão de eventos que ocorrem no animal experimental onde sua condição se deteriora do “normal” ou animal saudável. Por exemplo, em estudos que envolvem infecção, câncer ou artrite, como a condição progride, pode haver dor e angústia crescentes. Eventualmente, a condição do animal pode chegar a um ponto em que se torna óbvio que, a menos que uma ação seja tomada para acabar com a condição, o animal irá morrer. Este ponto da escala é chamado de “sinais clínicos limitantes”. O Guideline da Federação Europeia de Associações em Ciência de Animais de Laboratório (FELASA, 1994) descreve os principais sinais limitantes que podem ser observados e sua natureza, classificados em fraco, moderado ou grave (Tabela 1). Quando os sinais limitantes da intervenção são desconhecidos, um estudo piloto usando alguns animais sob observação cuidadosa pode fornecer as informações para permitir que o PFH seja encontrado.
Para a maioria dos estudos, há 5 aspectos da condição do animal que devem ser avaliados e, para tal, é imprescindível o treinamento do pessoal em observação clínica e de extrema importância o conhecimento do “normal” da espécie com a qual está trabalhando:
- Mudanças no peso corporal e mudanças relacionadas ao consumo de alimento e água;
- Aparência física externa (pelos descuidados e arrepiados, pálpebras fechadas, corrimento ocular/nasal, postura encurvada, etc);
- Sinais clínicos (alterações das frequências cardíaca e respiratória, dispneia, alterações na defecação, temperatura corporal, etc);
- Mudanças de comportamentos não provocados (ex. vocalização, autotrauma);
- Respostas comportamentais a estímulos externos (ex. agressividade).
Tabela 1. Classificação da intensidade e a natureza dos sinais clínicos limitantes observados em animais em experimentação
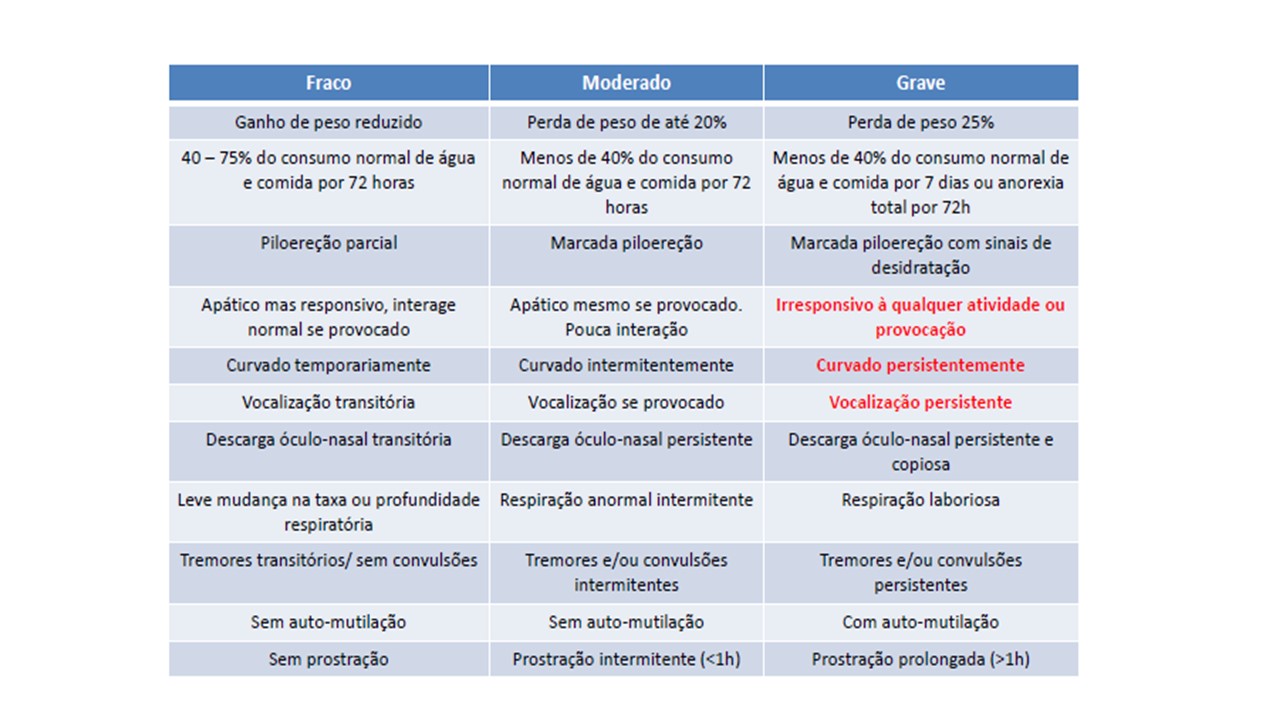
Fonte: adaptado de Guideline FELASA, 1994.
Medir e registrar mudanças no comportamento, na aparência física e no peso corporal devem ser consideradas para todas as avaliações de PFH. Ao saber os períodos críticos do experimento, são necessários de 2 a 3 observações do animal/dia, e dependendo do experimento, como nas intoxicações agudas, a observação pode ser a cada hora.
O desenvolvimento de checklists pode ajudar a determinar o apropriado PFH, e é importante que seja baseado no procedimento experimental ao qual o animal está sendo submetido. Por exemplo, na pesquisa com câncer, acrescentar aos parâmetros citados acima a CAQUEXIA [perda de peso que exceda 20% do peso vivo (p.v.) ou de um animal similar normal – levando em conta a massa tumoral]; ULCERAÇÃO/infecção no local do tumor; INVASÃO dos tecidos adjacentes ao local do tumor; TRAUMA induzido persistente; TAMANHO – não deve exceder 5% do peso corporal normal ou 10% quando o experimento envolve tratamento do tumor (10% representa um típico tumor subcutâneo de 17mm de diâmetro em um camundongo de 25g ou 35mm em um rato de 250g).
No PFH para diabetes, todos os animais que apresentem sinais de coma dentro das primeiras 24/48h devem ser eutanasiados; qualquer animal que demonstrar postura de ponta dos pés ou de marcha lenta pesada devem ser eutanasiados. O médico veterinário e o investigador principal devem ser informados se mais de um sinal clínico ocorrer.
No PFH para doenças infecciosas, segundo Siems & Allen (1989), em um modelo de doença (ex. infecção crônica por Candida albicans sistêmica), entre outras medidas, o PFH é fixado quando a perda de peso é > 20% ou quando a temperatura corporal cai mais de 4ºC (ambos facilmente monitorizados).
Segundo a Resolução Normativa CONCEA n°25, de 29 de setembro de 2015, não pode haver demora entre reconhecer e agir. O bem-estar animal não é protegido por sistemas nos quais as decisões e as ações exijam longos comunicados ou burocracia demorada.
Em caso de aplicação do PFH, algumas perguntas importantes devem ser respondidas:
1) Com base em informações prévias do modelo específico em estudo, quais os sinais e sintomas que o animal pode apresentar com tal experimento? Em que momento ou qual o curso de tempo para o aparecimento dos primeiros sinais de dor/angústia? Ou, sabendo o curso de desenvolvimento do tumor ou da doença provocada no estudo, em que período os animais irão requerer mais atenção? [Se o curso da doença, sintomas ou efeitos adversos não são conhecidos, deve ser realizado um estudo piloto com poucos animais para observação atenciosa dos mesmos aos mínimos sinais de dor e desconforto (comparando com os animais controle), para estabelecer o PFH o mais precoce possível].
2) Quem é o membro da equipe de pesquisa que irá monitorar os animais e manter as anotações, além de tomar as decisões necessárias ao bem-estar dos animais, como retirá-los do experimento, tratá-los, fazer eutanásia ou informar o médico veterinário prontamente? Essa pessoa tem treinamento/experiência para isso?
3) Qual será a frequência de observação dos animais durante o curso da pesquisa e durante o período crítico para o animal?
4) Qual a decisão tomada para aqueles animais que mostrarem sinais ou sintomas severos inesperadamente?
5) Tenho um checklist com os sinais/sintomas aos quais está baseado meu PFH? (Se não, deve ser realizado um estudo piloto comparando os tratados aos animais controle para identificar os indicadores e estabelecer o PFH o mais precoce possível).
6) Há dados toxicológicos das substâncias que serão administradas no animal para previsão de sinais/sintomas decorrentes desta administração?
Depois de estabelecido e aprovado o PFH pela CEUA, os pesquisadores devem continuar a refinar o PFH quando possível e assegurar a realização do mesmo. Um PFH bem estabelecido para cada protocolo experimental reflete um alto padrão de bem-estar animal e pode refletir em um mais alto padrão de ciência.
No “GUIA DE PROCEDIMENTOS EXPERIMENTAIS E DE DOSES EM ROEDORES DE LABORATÓRIO”, na página da CEUA, pode-se encontrar um modelo básico de Checklist de PFH (https://www.unifal-mg.edu.br/ceua/area-do-pesquisador/orientacoes-gerais/).
REFERÊNCIAS
Pain and distress in laboratory rodents and lagomorphs. Report of the Federation of European Laboratory Animal Science Associations (FELASA) Working Group on Pain and Distress accepted by the FELASA Board of Management November 1992. Lab Anim. 1994 Apr;28(2):97-112. doi: 10.1258/002367794780745308. PMID: 8035572.
CONSELHO NACIONAL DE CONTROLE DE EXPERIMENTAÇÃO ANIMAL (CONCEA). Resolução normativa nº 25, de 29 de setembro de 2015. Dispõe sobre o capítulo “Introdução Geral” do Guia Brasileiro de Produção, Manutenção ou Utilização de Animais para Atividades de Ensino ou Pesquisa Científica. Diário Oficial da União, Brasília, DF, 02 out. 2015.
Siems, J. J., Allen, S. D. (1989). Early euthanasia as an alternative to death in chronic infectious disease studies using a systemic Candida albicans model. Abstr. Annu. Meet. Am. Soc. Microbiol., 89, 81.
